Gasdermin D (GSDMD)作为炎症小体驱动的焦亡途径的关键介质。
2024年2月7日,四川大学叶昊宇、杨建洪及吴文爽共同通讯在Science Advances在线发表题为“NU6300 covalently reacts with cysteine-191 of gasdermin D to block its cleavage and palmitoylation”的研究论文,该研究确定NU6300作为一种特异性的GSDMD抑制剂,与GSDMD的半胱氨酸-191共价相互作用,有效地阻断了其剪切,同时不影响较早的步骤,如ASC寡聚化和AIM2和NLRC4介导的炎症中的caspase-1加工。相反,NU6300强力地抑制了NLRP3炎症小体中的这些较早步骤,确认了对NLRP3-GSDMD途径的独特反馈抑制效应。
该研究揭示了GSDMD抑制剂的一个以前未定义的机制:NU6300影响了全长和N末端GSDMD的棕榈酰化,阻碍了N末端GSDMD的膜定位和寡聚化。体内研究进一步证明了NU6300在改善葡聚糖钠硫酸盐诱导的结肠炎和提高脂多糖诱导的脓毒症存活率方面的有效性。总的来说,这些发现突显了NU6300作为治疗炎症性疾病的有前途的首要化合物的潜力。
Gasdermin D(GSDMD)是一种重要的焦亡执行者,属于焦亡蛋白家族的成员之一,包括GSDMA、GSDMB、GSDMC、GSDMD、GSDME和DFNB59。它由两个结构域组成,一个为31千达的N端(GSDMD-N),另一个为22千达的C端(GSDMD-C),两者之间由一个连接区分隔。GSDMD-C的第一个柔性环位于GSDMD-N和连接螺旋之间,伸展并插入到GSDMD-N的口袋中,稳定全长蛋白的构象。激活后,炎性半胱氨酸蛋白酶切割GSDMD,产生和释放GSDMD-N和GSDMD-C。与此同时,全长GSDMD或N端GSDMD在半胱氨酸-191(C191)上棕榈酰化。然后,棕榈酰化的GSDMD-N与胞膜内叶酸性磷脂相互作用,在质膜内形成内径为10到15纳米的功能性孔道通过寡聚。过度的孔道形成导致胞膜完整性受损、细胞肿胀、白细胞介素-1β(IL-1β)和IL-18的分泌,最终导致焦亡细胞死亡。
NU6300抑制焦亡(图片源自Science Advances )
GSDMD作为焦亡执行者的关键作用使其成为免疫学领域的突出主题,与免疫防御和许多疾病相关。研究表明,GSDMD的删除或抑制显著减少焦亡并显著保护小鼠免受败血症的伤害,这是一种需要紧急医疗解决方案的致命病情。此外,GSDMD作为炎性小体信号通路的效应物,与多种人类疾病相关,包括非酒精性脂肪肝、心血管疾病、炎性肠病、2型糖尿病、类风湿性关节炎、癌症和阿尔茨海默病。因此,由于GSDMD在焦亡中的关键功能,它已经成为治疗炎性小体驱动疾病的理想和吸引人的靶点。
由于GSDMD是调节炎症性疾病的中心效应蛋白,因此开发直接靶向GSDMD的药物引起了极大兴趣。这些药物不仅为探索和建立研究焦亡的先前未知机制提供了重要见解,而且还为各种炎症性疾病的临床研究提供了一个有前途的途径。到目前为止,已有三种共价小分子报道直接靶向GSDMD:二硫代二乙胺(Dis)、灭活磺胺(NSA)和二甲基富马酸酯(DMF)。这些小分子与GSDMD的半胱氨酸-191/192(C191/192)的游离巯基反应,从而阻止孔道形成和焦亡。
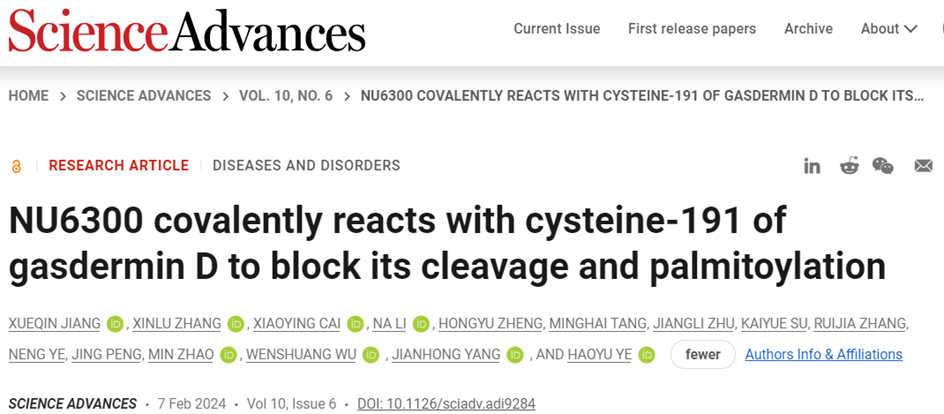
该研究进行了一项基于乳酸脱氢酶(LDH)释放的小分子筛选,以识别焦亡细胞死亡的抑制剂。该研究发现NU6300是焦亡细胞死亡的有效抑制剂,可以减少人单核细胞和小鼠巨噬细胞中的细胞因子释放和碘化丙啶(PI)摄取。从机制上讲,NU6300共价修饰人类GSDMD中的C191,阻止其剪切,但不影响前期步骤,如APOPTOSIS相关的斑点状蛋白含有一个半胱氨酸蛋白结构域(ASC)寡聚和AIM2和NLRC4炎性小体中的半胱氨酸蛋白酶-1处理,证明了其对GSDMD的高选择性。相反,该研究观察到NU6300在NLRP3炎性小体的前期步骤上有强效抑制作用,暗示了在靶向GSDMD时对NLRP3炎性小体的反馈抑制作用。
该研究发现,NU6300影响了全长和N端GSDMD的棕榈酰化,导致随后的GSDMD-N膜定位受阻。此外,该研究证明NU6300的给药减轻了炎性细胞因子的释放,并在结肠炎和败血症小鼠模型中提供了保护。总的来说,该研究确定了NU6300作为直接靶向GSDMD的抑制剂,并具有成为炎性疾病干预的潜在药物的前景。
原文链接:https://www.science.org/doi/10.1126/sciadv.adi9284













